2021中国医药研发创新与国际化论坛在沪顺利召开
发布日期:2021-10-27来源:中国药品监督管理研究会

围绕实现国家十四五发展规划和二零三五远景目标,为促进我国药品研发事业的创新与发展,搭建国内外药品研发与监管的国际化交流平台,结合伴随诊断和精准医疗的全球化发展趋势,帮助国内企业走出去,国外经验引进来,10月22日下午,由中国药品监督管理研究会主办,药品监管研究国际交流专业委员会和徕博科医药研发(上海)有限公司承办的 “2021首届中国医药研发创新与国际化研讨会”在沪顺利举办。

本次研讨会,以“多维视角,共话创新”为主题,邀请了国家食品药品审核查验中心、跨国药企、中国创新药企、临床研究中心与机构、CRO 等众多领域的专家学者进行跨界对话,共同探讨和交流了复杂的国内外形势给药品研发与创新带来的新机遇、新挑战和新举措,探索中国医药行业研发的国际化之路。

中国药品监督管理研究会药品监管研究国际交流专业委员会薛斌主委主持开幕式
药品监管研究国际交流专业委员会薛斌主任委员主持了开幕式,中国药品监督管理研究会张伟会长、徕博科医药研发(上海)有限公司全球高级副总裁兼亚太区负责人毕红钢博士代表主办方与承办方致辞,国家食品药品审核查验中心检查二处GLP/GCP检查员张蓉、国家药监局药品审评检查长三角分中心杨进波主任、复旦大学附属华山医院抗生素研究所副所长张菁教授、江苏省人民医院机构主任柴怡博士、德琪医药董事长兼首席执行官梅建明博士、强生制药亚太转化科学卓越中心肺癌转化医学研究负责人周龙恩博士、徕博科副总裁兼中国区总经理夏文璐女士等嘉宾随后做了精彩的主题报告和专家讨论。

中国药品监督管理研究会张伟会长致辞
作为本次研讨会的主办单位,张伟会长代表中国药品监督管理研究会进行了欢迎致辞。张伟会长指出,过去很多年里,我国药品监管体系和监管能力一直存在诸多的瓶颈与制约,欣慰的是,国家药品监督管理局多年来在审评与审批改革方面不断推出创新的举措,极大地促进了药品行业的创新与发展。此外,“十三五”规划中,将发展精准医疗确定为国家战略,使得我国在伴随诊断领域加速与国际接轨,伴随诊断试剂开发企业与药企开展深度合作将成为新的趋势,随着越来越多伴随诊断指导政策的推出,药品与试剂的注册申报也将更加有制可依、有规可守、有序可循,药品与诊断试剂将逐步实现同步研发、同步注册和同步上市。在产业高速发展之时,需要通过行业内不断的相互交流,及时吸取国际先进经验,不断取长补短,让中国医药产业走的更快,更稳。

徕博科医药研发(上海)有限公司全球高级副总裁兼亚太区负责人毕红钢博士致辞
徕博科医药研发(上海)有限公司全球高级副总裁兼亚太区负责人毕红钢博士在欢迎致辞中指出,在国家医药审批审评改革创新政策的引领支持下,中国的生物医药创新发展实现了巨大的飞跃,研发创新的国际化正进入空前的高速发展期,最新的对标已是国际前沿水平,中国新药研发已在多个靶点和治疗领域引领国际潮流,中国成为新药研发强国已经不再是遥远的未来。早在2008年,当时徕博科的前身,科文斯就有幸和国家局的领导和老师们开始了创新和国际化的道路,如今十多年过去了,科文斯在中国已经高速发展了近23年,并在2021年正式更名为徕博科,承前启后,徕博科继续以全球优秀的一站式临床试验解决方案和国际跨网络的临床实验研究能力,秉承“改善健康与生活”的全球使命,力行支持中国创新药企的国际化发展需求,为中国医药行业的发展做出更多的贡献。

国家食品药品审核查验中心检查二处GLP/GCP检查员张蓉主题报告
药品的审核与查验政策与指导方针是所有药研人密切关注的领域,本次研讨会上,国家食品药品审核查验中心检查二处检查员张蓉以“加强药物非临床研究监管,助力创新药物研发”为主题展开了阐述,解读了核查中心的历史沿革、组织架构、主要职能、药物非临床研究监管的意义与监管趋势、相关法律法规技术指南与判定标准等关键内容,她表示,药物非临床研究是探索药物与集体之间作用机理、研究药物有效性和安全性的起始环节,是药物研发的基础性工作,其结果对于在人体开展药物有效性和安全性临床研究具有重要指导意义,也是药品审评部门批准药物临床试验申请(IND)的重要评价指标,药品监管部门、科技部门、行业协会以及非临床研究机构等各方应共同努力,推动药物非临床研究高质量发展。

国家药监局药品审评检查长三角分中心杨进波主任主题报告
2020年12月22日,国家药监局药品审评检查长三角分中心正式挂牌成立,经过近一年的建设,分中心已经取得了不少的进展,国家药监局药品审评检查长三角分中心杨进波主任在本次研讨会上特别介绍了分中心的职能、建设与未来规划,他谈到,分中心的药审中心需要建立“一体化”协调机制,着重在沟通交流、立卷指导服务、受理、技术审评等9项任务,核查中心侧重于注册现场核查任务,正加紧构建核查工作制度和质量体系,加强核查能力建设。他表示,分中心会做到四个统一:统一审评体系,统一业务流程,统一审评标准和统一审评团队。
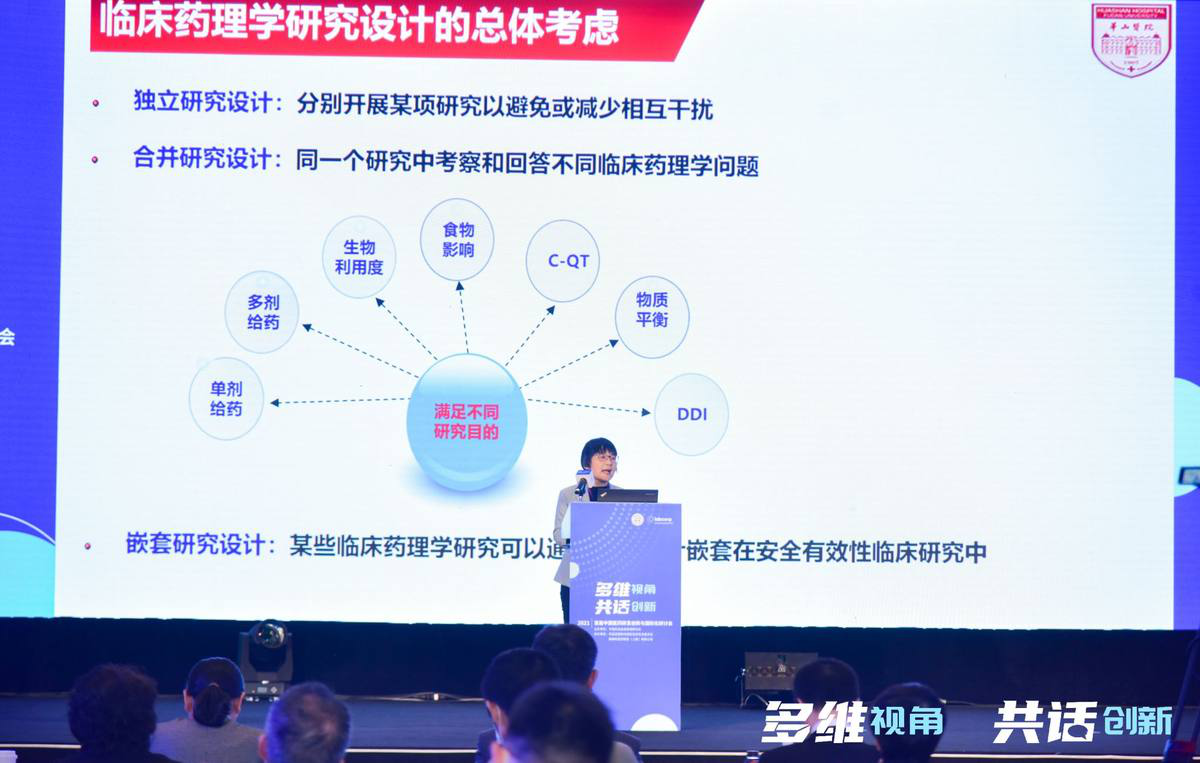
复旦大学附属华山医院抗生素研究所副所长张菁教授主题演讲
谈到创新药在中国临床药理研究的发展和前景,复旦大学附属华山医院抗生素研究所副所长、临床药理学教授张菁博士详细解读了临床药理学研究方面的相关指导原则、中西差异、研究内容、研究时机以及研究方法,介绍了模型引导的药物研发(MIDD)理念贯穿创新药研发的全过程,分享了临床药理学研究设计的总体考量因素。她表示,需要构建完善的MIDD研发模式,确定合理的临床给药方案,并降低临床试验的风险,并且应该从临床早期、中期和后期综合进行考虑。

德琪医药董事长兼首席执行官梅建明博士主题演讲
近年来,我国医疗行业持续繁荣,生物制药产业涌现了不少优秀的创新药企,并逐渐走向国际化扩张之路。国内创新药领域的新锐公司德琪医药创始人、董事长兼首席执行官梅建明博士从本土创新药企的视角介绍了德琪医药的研发管线以及国际临床试验进程。他谈到,我国在全球制药领域正在加速追赶并超越其它地区,2016至2020年间,中国临床试验I至IV期数量逐年增加,2020年,我国在全球药物临床实验的占比已接近25%,较2016年几乎翻倍,中国创新药企在世界影响力持续提升。德琪医药的国际化进程也走的很快,在美国、澳洲等地陆续开展了诸多临床试验,公司在First-in-class和Best-in-class领域拥有较大的潜力。

强生制药亚太转化科学卓越中心肺癌转化医学研究负责人周龙恩博士主题演讲
本次研讨会也有幸请到了来自强生制药亚太转化科学卓越中心肺癌转化医学研究负责人周龙恩博士,他从实际案例出发,介绍了精准医疗背景下的转化医学在肿瘤研究中的应用现状以及未来前景,以及模型数据整合、生物标志物指导下的临床试验设计、人工智能等在转化精准医学领域将会得到更广泛的应用。

徕博科中国区总经理、副总裁夏文璐女士主持专家论坛
主旨演讲报告后,研讨会开展了专家论坛,由徕博科中国区总经理、副总裁夏文璐女士主持,复旦大学附属华山医院抗生素研究所副所长张菁教授、江苏省人民医院机构主任柴怡博士、德琪医药董事长兼首席执行官梅建明博士、强生制药亚太转化科学卓越中心肺癌转化医学研究负责人周龙恩博士、徕博科医药研发(上海)有限公司全球高级副总裁兼亚太区负责人毕红钢博士共同参与了对话。
专家们在研讨环节中表示,中国创新药国际化道路上比较大的挑战是缺乏综合性、跨学科并具有国际化视野的人才,国际化之路上,必须要广纳这方面的人才,建立更多的指导原则,设计更好的预案以指导试验的开展,创新药企应去寻找更多的靶点开展FIC和BIC类型新药的研发。执行层面,临床试验各方应通力配合加快各自流程审批,而CRO也应该从国际视角提供更加灵活的人才服务去支持中国创新药企开展的国际化临床试验,多方共同合作加速医药研发进程。
会议结束,与会者们纷纷表示意犹未尽,认为今天这个主题的研讨会对促进国内医药研发国际化道路的健康发展非常有价值,非常期待明年能够继续参加下一届的研讨会。
本站由中国药品监督管理研究会主办 版权所有 未经许可禁止转载或建立镜像
Copyright © CNCSDR All Rights Reserved
备案序号:京ICP备14043040号
中国药品监督管理研究会信息中心建设和维护
地址:北京市东城区 | 邮编:100050
